高中化學競賽/價層電子對互斥模型
< 高中化学竞赛
我們已在高中初步學習了價層電子對互斥模型,並且了解了價層電子對數的計算公式(a為中心原子的族序數,b為配位原子達到穩定結構需要的電子數,x為配位原子的數量)。在這裡我們會學習一種新的判斷VSEPR模型的方法。
對於以A原子為中心原子的某一分子(或離子)AXn,我們將其寫為AXnEm,E表示中心原子A上的孤對電子對數。那麼有:
其中a為A的族序數,b為X的化合價,q為離子所帶電荷數(帶正負號)。
例題
題目
計算下列微粒的中心原子上的孤對電子對數:,,,。
答案
我們令,便可寫出AYz這個通式。這裡的z表示價層電子對數。這樣,我們便可以與高中階段聯繫起來了。
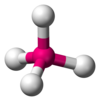
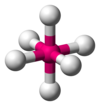
z與VSEPR模型對應關係如下表:
| z | 2 | 3 | 4 | 5 | 6 |
| VSEPR模型 | 直線型 | 平面三角形 | 正四面體型 | 三角雙錐型 | 正八面體型 |
| 球棍模型 | 
|
|

|
|
我們捨去孤對電子,便得到了粒子的實際構型。但孤對電子實際位置需要通過下列幾種斥力順序判斷:
- 孤對電子對-孤對電子對>孤對電子對-鍵合電子對>鍵合電子對-鍵合電子對
- 雙鍵-單鍵>單鍵-單鍵
- 電負性弱-電負性弱>電負性弱-電負性強>電負性強-電負性強
例題
題目
已知四氟化硫分子,判斷其VSEPR模型和空間構型。
答案
,故屬,z=5。其VSEPR模型為三角雙錐形。
分子中有一對孤對電子,它可能出現的位置有兩種——(1)中心原子所在的三角形平面外;(2)中心原子所在的三角形平面內。
考慮斥力:(1)分子中有3個90度的孤對電子對-鍵合電子對,三個90度的鍵合電子對-鍵合電子對,三個120度的鍵合電子對-鍵合電子對;(2)分子中有兩個90度的孤對電子對-鍵合電子對,兩個120度的孤對電子對-鍵合電子對,四個90度的鍵合電子對-鍵合電子對,一個120度的鍵合電子對-鍵合電子對。
由於120度電子對之間的斥力遠小於90度電子對,可以忽略不計,所以(2)的斥力比(1)穩定。
故四氟化硫分子呈變形四面體型(又稱蹺蹺板型),如下圖。

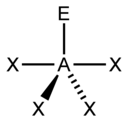
一般來講,確定了z、m之後,分子構型如下表所示:
| 電子對數 | m=0 | m=1 | m=2 | m=3 |
|---|---|---|---|---|
| 2 | ||||
| 3 | 
|

|
||
| 4 | 
|

|

|
|
| 5 | 
|
|

|

|
| 6 | 
|

|

|
T型 |










